У туберкулезной палочки обнаружено слабое место
Микроб Mycobacterium tuberculosis, вызывающий у человека туберкулез, возможно, имеет т.н. «ахиллесову пяту». Этой бактерии, для того, чтобы выжить, требуется определенный фермент. Если его ингибировать, то можно убить всего микроба, как показало недавно проведенное в Университете Брауна (США) исследование.
В серии лабораторных опытов ученые под началом доцента Джейсона Селло научились химически подавлять активность клеточного энзима ClpP («клип-пэ»), что до сих пор не было сделано никем из производителей лекарств от туберкулеза. Между тем, уже лет десять о ClpP говорили, как о потенциальной мишени новых, особых антибиотиков, перед которыми смертоносные формы туберкулеза были бы бессильными.
В клетке микобактерии фермент «клип-пэ» играет роль мусорщика, разрушая те белки, которые микробу больше не нужны. Этот фермент есть у многих бактерий, однако еще одно, предыдущее исследование показало, что Mycobacterium tuberculosis жить без ClpP не может. Если ген, который кодирует сей энзим в клетке микроба отключить, возбудитель туберкулеза погибнет.
Перед собой и своими студентами химик Джейсон Селло поставил задачу найти низкомолекулярное вещество, которые бы ингибировало «клип-пэ». Специалисты из Брауна, двигаясь в оном направлении, синтезировали 14 различных бета-лактонов со схожей химической структурой. Испытаны эти антибиотики были на лабораторной версии микобактерии — Mycobacterium smegmatis. Этот вид микробов часто используют при исследованиях, т.к. он не вызывает у человека инфекционных заболеваний. Вместе с тем, смегматис — близкий родственник туберкулезной палочки.
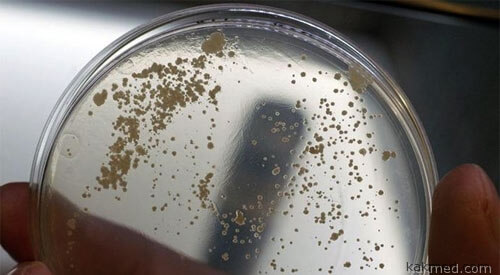
Четыре новых бета-лактона из 14-ти, при обработке ими культур бактерий Mycobacterium smegmatis, выросших в чашках Петри, подействовало на микробов убийственно. Дабы проверить отраву на настоящих палочках Коха, Селло и коллеги выслали образцы веществ в Институт туберкулеза при университете штата Иллинойс. Там эксперты в белых скафандрах разберутся в том, насколько эффективны экспериментальные ингибиторы.
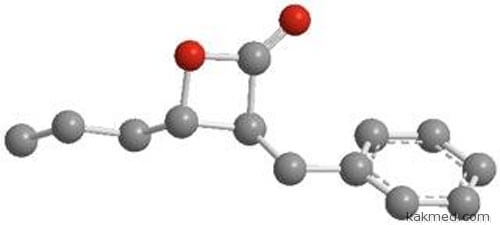
Самым мощным из новых антибактериальных агентов оказался тот, чья химическая формула наиболее отличалась от ранее известных ингибиторов бактериального фермента ClpP. По силе это вещество (бета-лактон-7) сопоставимо с прославленным антибиотиком стрептомицином. Лактон связывается в микробной клетке с двумя протеинами, которые входят в состав «клип-пэ». Тем самым фермент инактивируется.